《结构化学》补充习题答案(化学专业)
第三章 共价键和双原子分子的结构化学
1.填空题
(1) (1sg)2(1su)2(1πu)4(2sg)2, KK (s2s)2(s![]() )2(s2pz)2(π2px)2(π2py)2(π
)2(s2pz)2(π2px)2(π2py)2(π![]() )1(π
)1(π![]() )1
)1
(2) 低于,高于,等于; (3) s,s,p (4) d,π; (5) H![]() ,He
,He![]() ,C
,C![]() ,NO;
,NO;
(6) 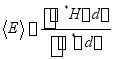 ≥E0; (7) 4; (8) =,>,>。(CO和N2的键级都为3;CO的键长为112.8 pm,键能1071 kJ/mol,N2的键长为109.8 pm,键能为941.6 kJ/mol,参见教材P 86,CO是键能最大的双原子分子。 (9) H2、N2、CH4,H2、N2; (10) 6; (11) dxy, δ;
≥E0; (7) 4; (8) =,>,>。(CO和N2的键级都为3;CO的键长为112.8 pm,键能1071 kJ/mol,N2的键长为109.8 pm,键能为941.6 kJ/mol,参见教材P 86,CO是键能最大的双原子分子。 (9) H2、N2、CH4,H2、N2; (10) 6; (11) dxy, δ;
(12) py, dxy; (13) ![]()
2.选择题
(1) | (2) | (3) | (4) | (5) | (6) | (7) | (8) | (9) | (10) | (11) | (12) |
B | BC | D | B | A | B | D | C | C | E | C | B |
(13) | (14) | (15) | (16) | (17) | (18) | (19) | (20) | (21) | (22) | (23) |
|
D | A | B | B | B | D | A | A | B | C | D |
|
3. 简答题
(1) 请按原子单位写出H2+在定核近似条件下的薛定谔方程,并指明能量算符中各项的意义。
答:答:①He+离子:![]()
②He 原子:![]()
③ H2+离子:![]()
④ H2分子:![]()
(2) HF的σ成键分子轨道可表示为:![]() ,H原子的1s轨道能为-13.6 eV,F的2p轨道能为-17.4 eV,则c1,c2组合系数哪个大?
,H原子的1s轨道能为-13.6 eV,F的2p轨道能为-17.4 eV,则c1,c2组合系数哪个大?![]() 和
和![]() 分别表示什么?
分别表示什么?
答:根据分子轨道理论,两个能量不同的原子轨道组合成两个分子轨道时,能量较低的成键分子轨道中含低能量的的原子轨道成分多,能量较高的反键轨道中含能量较高的原子轨道成分多。F的2p轨道能低于H的1s轨道能。故![]() 。
。![]() 和
和![]() 分别表示H的1s轨道和F的2p轨道对HF成键分子轨道的贡献。
分别表示H的1s轨道和F的2p轨道对HF成键分子轨道的贡献。
(3) 在NO2+, NO+, NO, NO-系列中,哪个具有最强的键?
答:根据核外电子排布,
NO2+:(1s)2(2s)2(3s)2(4s)2(1π)4(5s)1 键级为2.5
NO+: (1s)2(2s)2(3s)2(4s)2(1π)4(5s)2 键级为3
NO: (1s)2(2s)2(3s)2(4s)2(1π)4(5s)2(2π)1 键级为2.5
NO-: (1s)2(2s)2(3s)2(4s)2(1π)4(5s)2(2π)2 键级为2
同种分子中键级越大,键能越大,成键越强,因此,NO+键最强。
(4) 写出OF,OF+,OF–的价层电子排布,指出其键级和磁性,比较键长和键能的大小顺序。
答:
键级:OF+ > OF > OF��������;键长:OF+ < OF < OF��������
| 基态电子组态 | 键级 |
OF | (1σ)2(2σ)2(3σ)2(4σ)2 (5σ)2 (1π)4(2π)3 | 1.5 |
OF - | (1σ)2(2σ)2(3σ)2(4σ)2 (5σ)2 (1π)4(2π)4 | 1 |
OF + | (1σ)2(2σ)2(3σ)2(4σ)2 (5σ)2 (1π)4(2π)2 | 2 |
键长:OF - > OF > OF +
键能:OF - < OF < OF +
(5) 简述原子轨道有效地形成分子轨道的条件。
答:对称性匹配原则,最大重叠原则,能量相近原则。
在上述成键三原则中,只有满足对称性匹配原则才能发生有效重叠,才能有效地形成分子轨道,因此对称性原则是能否形成分析轨道的重要判据。
(6) 说明氟分子特别活泼的原因。
答:F2[KK(s2s)2(s![]() )2(s2pz)2(π2px)2(π2py)2(π
)2(s2pz)2(π2px)2(π2py)2(π![]() )2(π
)2(π![]() )2]
)2]
由于成键作用与反键作用相抵消,所以实际上成键的只有一对s2pz电子,形成一个s键。因此,氟易于和其他原子化合,形成较强的离子键或共价键。
(7) 用分子轨道理论解释Li2分子能够稳定存在的原因。
答:两个Li原子的价层2s轨道之间可以形成σ2s成键和σ2s*反键轨道,当它们的2s电子填入σ2s成键轨道后,键级为1,体系的总能量降低,即Li2的总能量低于两个Li原子的能量之和,所以,Li2分子能够稳定存在。
(8) 以z轴为键轴,按对称性匹配原则,下列各对原子轨道能否组成分子轨道,若能,写出分子轨道的类型:
①s,dz2 ②dxy,dxy ③dyz,dyz ④dyz,dxz ⑤s,dxy
答:①σ ②δ ③ π ④不能 ⑤不能
(9) 氮分子的电子组态早期曾写成N2[KK(s2s)2(s2s*)2(s2pz)2(π2px)2(π2py)2],指出此种写法的不正确之处,写出正确组态,说明其正确性。
答:从早期写法可以看出,成键轨道有(s2pz)2,(π2px)2,(π2py)2,解释了N2的三重建的结构。但是它与光电子能谱的数据不符。根据光电子能谱分析,电子占据最高能量轨道是s型,次高轨道才是π型。而且也不能解释氮分子的特殊稳定性以及N2作为配体多为端基配位原因。这是早期电子组态的写法,忽略了对称性相同和能量比较接近的分子轨道之间的相互作用。考虑这种类型分子轨道之间的s-p混杂作用,氮分子正确的电子组态写法为
N2:(1sg)2(1su)2(2sg)2(2su)2(1πu)4(3sg)2
可以看出最高占据轨道是3sg,是s型,次高占据轨道是1πu,是π型,同光电子能谱的结果是一致的;通过计算得出3sg、2su电子的几率密度主要集中在核的外侧,形成孤对电子, 所以N2多以端基配位,3sg、2su分别具有弱成键和弱反键的性质。 成键的轨道是 (2sg)2(1πu)2,相当于一个s键,两个π键,由于这三个成键轨道能量都很低,所以N2的三重建特别的稳定。
(10) 用分子轨道理论写出N![]() 、O
、O![]() 和F
和F![]() 的电子组态、键级,并预测能否稳定存在,它们的键长与其中性分子相对大小如何?
的电子组态、键级,并预测能否稳定存在,它们的键长与其中性分子相对大小如何?
答:N![]() :(1sg)2(1su)2(2sg)2(2su)2(1πu)4(3sg)1],键级=2.5,能稳定存在,键长rN
:(1sg)2(1su)2(2sg)2(2su)2(1πu)4(3sg)1],键级=2.5,能稳定存在,键长rN![]() > rN
> rN![]()
O![]() : KK(s2s)2(s
: KK(s2s)2(s![]() )2(s2pz)2(π2px)2(π2py)2(π
)2(s2pz)2(π2px)2(π2py)2(π![]() )1(π
)1(π![]() )0],键级=2.5,能稳定存在,rO
)0],键级=2.5,能稳定存在,rO![]() < rO
< rO![]()
F![]() :KK(s2s)2(s
:KK(s2s)2(s![]() )2(s2pz)2(π2px)2(π2py)2(π
)2(s2pz)2(π2px)2(π2py)2(π![]() )2(π
)2(π![]() )1],键级=1.5,能稳定存在,r F
)1],键级=1.5,能稳定存在,r F![]() < r F
< r F![]()
(11) 写出O2-和N2-的分子轨道表达式,计算键级并说明是否具有顺磁性。(北京师范大学,2007年)
答:O![]() : KK(s2s)2(s
: KK(s2s)2(s![]() )2(s2pz)2(π2px)2(π2py)2(π
)2(s2pz)2(π2px)2(π2py)2(π![]() )2(π
)2(π![]() )1],键级=1.5,有顺磁性
)1],键级=1.5,有顺磁性
N![]() :(1sg)2(1su)2(2sg)2(2su)2(1πu)4(3sg)2(1πg)1],键级=2.5,有顺磁性
:(1sg)2(1su)2(2sg)2(2su)2(1πu)4(3sg)2(1πg)1],键级=2.5,有顺磁性
(12)写出N![]() -的分子轨道排布式,计算键级,并说明是否具有顺磁性?(北京师范大学,2008年)
-的分子轨道排布式,计算键级,并说明是否具有顺磁性?(北京师范大学,2008年)
答:N![]() :(1sg)2(1su)2(2sg)2(2su)2(1πu)4(3sg)2(1πg)2],键级=2,有顺磁性(两个电子分占1πg)
:(1sg)2(1su)2(2sg)2(2su)2(1πu)4(3sg)2(1πg)2],键级=2,有顺磁性(两个电子分占1πg)
(13) 用MO理论说明H![]() 的键长比H2长,而O
的键长比H2长,而O![]() 的键长比O2短的原因。
的键长比O2短的原因。
答:H![]() 比H2在成键轨道(s1s)上少一个电子,H
比H2在成键轨道(s1s)上少一个电子,H![]() 的键级为0.5,H2的键级为1。
的键级为0.5,H2的键级为1。
O![]() 比O2在反键轨道(π
比O2在反键轨道(π![]() )上少一个电子,O
)上少一个电子,O![]() 的键级为2.5,O2的键级为2。
的键级为2.5,O2的键级为2。
(14) CO是一个极性较小的分子还是极性较大的分子?其偶极矩的方向如何?为什么?(为什么CO分子用C端原子配位?)
答:CO是一个极性很小的分子,偶极矩方向由氧原子指向碳原子。
CO是三重键分子,其3s、4s和1π上的电荷密度中心都不同程度地偏向氧,而最外层5s上的电荷密度中心却偏向于碳。使总的电荷密度中心偏移不大,因而CO分子的偶极矩很小。
(15) 有3个振动吸收带,其波数分别为1097cm-1,1580cm-1,和1865cm-1,它们被指源为是由O2、O2+和O2-所产生的,请指出哪个吸收带是属于O2-的。
答:O2、O2+和O2-的键级分别为:2、2.5和1.5。键级越大,键长越小,力常数越大,从而波数也越大。由于O2-的键级最小,所以其波数也最小,即1097 cm-1。
4. 计算题
(1) 已知某分子的远红外光谱线![]() =20.08,39.16,58.25,77.32,96.40cm-1,计算该分子的转动惯量及核间距。(已知该分子的折合质量为1.812×10-24g)
=20.08,39.16,58.25,77.32,96.40cm-1,计算该分子的转动惯量及核间距。(已知该分子的折合质量为1.812×10-24g)
解:相邻谱线的平均间隔为19.08cm-1,远红外光谱为转动光谱,因此转动常数为:![]()
转动惯量为:
![]()
核间距为:![]()
(2) 已知1H127I的核间距为161.3 pm,试计算HI的转动惯量和转动常数。(相对原子质量:H:1.008,I:126.9)
解:![]()
![]()
(3) 在HI的振动光谱中,观察到2230 cm-1处有一强吸收峰。若将HI的简正振动看做谐振子,则: ①说明此简正振动是否为红外活性;②计算HI的简正振动频率;③计算零点能; ④计算HI简正振动的力常数。
解:(1)极性分子,此简正振动为红外活性;
(2)![]() ;
;
(3)![]()
=2.215×10-20 J
(4)约化质量:
![]()
![]()
=290.8 N·m-1
1